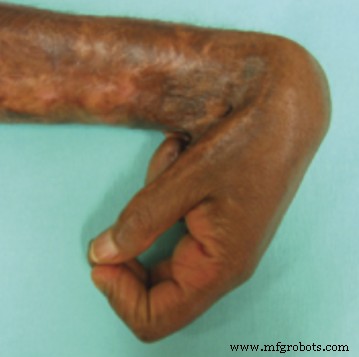
Gambar 1 Pembentukan bekas luka hipertrofik dengan kontraktur sendi Aarabi S, Longaker MT, Gurtner GC (2007) Pembentukan Bekas Luka Hipertrofik Setelah Luka Bakar dan Trauma:Pendekatan Baru untuk Pengobatan. PLoS Med 4(9):e234. doi:10.1371/journal.pmed.0040234 – http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.0040234
Ini bisa menarik minat kita jika kita ingin membuat "bekas luka buatan", misalnya untuk memperbaiki dinding perut setelah hernia; di mana kita bisa menggunakan, Phasix™ Mesh yang terbuat dari Poly-4-hydroxybutyrate (P4HB) untuk menambal cacat dinding.
Untuk mencapai integrasi fungsional implan apa pun, kita harus mendorong diferensiasi sel (yaitu memberikan setiap sel jenis dan fungsinya yang spesifik) dan menghindari kemungkinan sistem kekebalan menolak implan. Kami dapat melakukan ini dengan menggunakan nanomaterial sebagai 'pembawa' untuk mengirimkan biomolekul dan sebagai sinyal untuk mendorong proses ini.
Misalnya, kombinasi nanomaterial dan antibodi dapat digunakan untuk meningkatkan respon imun, seperti dalam memerangi kanker (antibody-modified iron oxide nanopartikel).
Beberapa bahan nano sendiri sudah memiliki efek penghambatan atau stimulasi langsung (tergantung pada bahannya) pada respon imun (logam mulia, nanopartikel oksida logam, serium oksida atau dendrimer adalah beberapa contohnya). Jadi, hanya dengan melapisi permukaan implan dengan nanopartikel tersebut, kita sebenarnya dapat menghentikan serangan sistem kekebalan terhadapnya. [1]
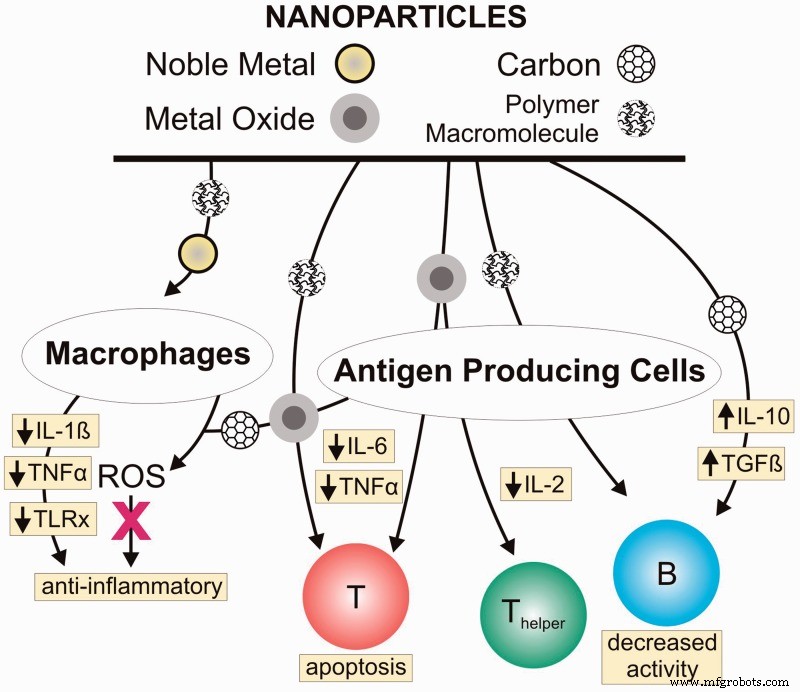
Gambar 2 Nanomaterials dengan efek penghambatan langsung pada respon imun Ngobili Terrika A, Daniele Michael A. Nanopartikel dan imunosupresi langsung.1 Mei, 2016 Experimental Biology and Medicine 106 Volume:241 issue:10, pages:1064-1073; https://doi.org/10.1177/1535370216650053 https://journals.sagepub.com/doi/abs/10.1177/1535370216650053
Strategi untuk melumpuhkan nanomaterial &biomolekul pada permukaan implan
Seperti yang telah kami sebutkan, ada dua alasan utama keinginan untuk melapisi permukaan implan:baik untuk meningkatkan biokompatibilitasnya (untuk mencegah sistem kekebalan menyerangnya) atau untuk memperbaiki biomolekul yang merangsang dan mengarahkan proliferasi sel (untuk menggantikan implan dengan jaringan pasien sendiri).
Ide untuk menanamkan perancah biodegradable (dilapisi dengan faktor pertumbuhan) untuk diganti dari waktu ke waktu oleh jaringan pasien adalah subjek yang telah kita bahas di Dari PLA hingga Bio-printing:alat fiksi ilmiah untuk bidang medis . Perancah seperti itu masih dalam tahap penelitian tetapi hanya beberapa tahun sebelum kita berpotensi mulai melihat mereka memasuki praktik klinis.

Peningkatan biokompatibilitas bahan asing merupakan kebutuhan industri saat ini. Untuk memastikan bahwa tubuh manusia tidak menolak biomaterial yang ditanamkan, kita harus menempelkan lapisan (kompleks nanomaterial atau biomolekul-nanomaterial) yang mengatur sistem kekebalan ke permukaan implan kita. Jadi, ketika sel sistem kekebalan terlalu dekat dengannya, lapisan tersebut menghambat sel dan mencegah timbulnya reaksi inflamasi di sekitar implan.
Tapi bagaimana kita bisa membuat lapisan seperti itu?
Pada dasarnya ada dua cara untuk 'menempelkan' lapisan pada implan:imobilisasi non-kovalen dan imobilisasi kovalen.
Imobilisasi non-kovalen (NCI):
NCI adalah strategi paling sederhana dan termurah untuk melapisi implan, tetapi sangat tergantung pada seberapa hidrofilik bahan implan. Ini didasarkan pada muatan elektrostatis yang akan menghasilkan gaya tarik menarik antara material yang kita tanamkan dan lapisannya.
Metode ini memberikan pelepasan biomolekul yang cepat, sehingga paling nyaman ketika kita tertarik pada respons yang tiba-tiba tetapi berumur pendek. Selain itu, keuntungan terbesarnya adalah biaya produksinya yang rendah.
NCI dapat diterapkan baik dengan adsorpsi (partikel kecil ukuran antara 500 dan 1 mm mengikuti permukaan) atau jebakan (partikel terperangkap dalam matriks berpori). [2]
Dalam jebakan, matriks dibuat dengan polimer yang larut dalam air seperti karagenan, kolagen terhidrolisis sebagian (gelatin), alginat, agar atau selulosa triasetat.[2, 3]
Namun apa yang terjadi jika bahan implan bersifat hidrofilik dan biomolekul bersifat hidrofobik (atau sebaliknya)?
Satu ide sederhana bisa menjadi solusi yang efektif:enkapsulasi biomolekul!

Enkapsulasi dalam enclosing biomolekul, yang dapat dengan mudah dilakukan dengan menggunakan polimer, seperti agarosa, poli(etilenglikol) (PEG), atau poli(N-vinilpirolidon) (PVP).
Contoh metode ini adalah penggunaan scaffold polisulfon yang diisi dengan larutan gel agarosa yang diinfuskan biomolekul untuk memandu regenerasi serabut saraf dan mengurangi peradangan [4].
Selain itu, jika perancah tidak cukup hidrofilik, strategi terbaik untuk melumpuhkan biomolekul adalah dengan mengenkapsulasinya dalam fase air yang terpisah melalui proses yang disebut air dalam minyak dalam air (atau emulsi ganda). Kami juga dapat melakukan penyerapan langsung pada permukaan material menggunakan pelarut organik.
Contoh polimer hidrofobik yang banyak digunakan dalam melumpuhkan biomolekul seperti faktor hormonal atau bahkan obat-obatan adalah poli(asam laktat-co-glikolat) (PLGA).
Imobilisasi kovalen (CI)
Imobilisasi kovalen terdiri dari menciptakan ikatan ireversibel antara biomolekul spesifik kami dan polimer yang implan kami dibuat menggunakan apa yang kami sebut agen pengikat silang; itu adalah senyawa kimia yang bereaksi terhadap kondisi fisik (panas, cahaya ...) dan membantu kita membuat ikatan yang dapat menghubungkan, misalnya, satu rantai polimer ke yang lain (kita dapat membayangkannya sebagai belenggu yang ditutup menggunakan cahaya atau panas untuk menghubungkan kedua polimer).
Metode ini menyebabkan efek yang tidak terlalu mendadak pada sistem kekebalan tubuh, meskipun lebih tahan lama; oleh karena itu lebih baik menggunakannya saat kita tertarik pada respons jangka panjang dan stabil.
Keuntungan utama dari metode ini adalah memungkinkan kita untuk melakukan diferensiasi jaringan bertingkat. Ini berarti kami dapat merancang titik pengikatan yang berbeda ke dalam perancah kami untuk faktor yang berbeda, sehingga menciptakan daerah dengan konsentrasi biomolekul yang berbeda untuk mempromosikan jaringan yang terstruktur secara berbeda.
Sebagai elemen dasar, perancah kolagen-glikosaminoglikan (CG) dapat digunakan (menggunakan karbodiimida sebagai pengikat silang mengingat keberadaan gugus NH2 di permukaannya).
Contoh imobilisasi kovalen adalah konjugasi polietilenimin (PEI) dengan heparin untuk membuat selubung untuk meningkatkan biokompatibilitas permukaan paduan NiTi [5].
Salah satu metode pengikatan silang yang semakin penting dalam beberapa tahun terakhir adalah penggunaan Akrilat untuk mempolimerisasi hidrogel PEG. Akrilat adalah gugus fungsi yang sensitif terhadap sinar ultraviolet. Gugus-gugus ini dapat ditambahkan ke peptida (atau faktor pertumbuhan lainnya), sehingga memandu sintesis dengan fotopolimerisasi perancah yang terdiri dari hibrida polimer-biomolekul. Kemungkinan mengintegrasikan proses ini dengan pencetakan 3D untuk memberikan pola struktural pada perancah kami menjadikan fotopolimerisasi salah satu metode yang paling relevan untuk melumpuhkan biomolekul.
Proses fotolitografi alternatif juga telah dirancang, misalnya, Institut Fraunhofer untuk Rekayasa Antarmuka dan Bioteknologi menggunakan metode yang terdiri dari menempelkan faktor pertumbuhan ke perancah CG menggunakan benzofenon (BP). [6, 7]
Target lain yang lebih selektif, karena keberadaannya yang lebih rendah terhadap gugus NH2, adalah gugus SH. Pengikat silang berbasis sulfhidril banyak digunakan untuk membuat lapisan yang menghambat aktivasi komplemen (komponen yang sangat penting dari sistem kekebalan) terhadap cangkok kita [8].
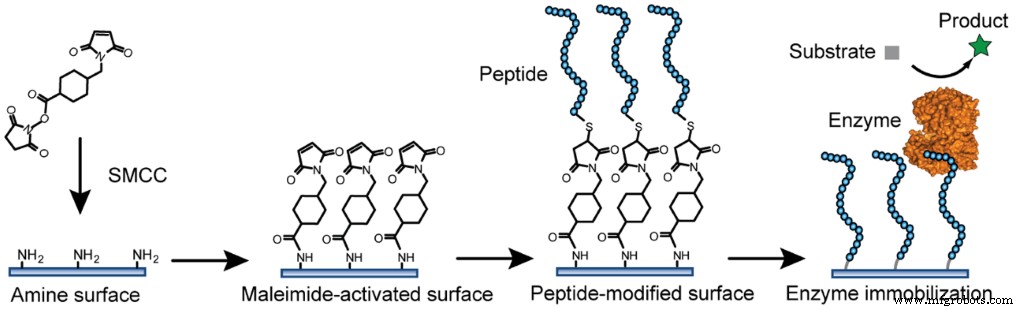
Gambar 3 Contoh Imobilisasi Enzim dengan Pengikatan Kovalen Fu J, Reinhold J, Woodbury NW (2011) Permukaan Modifikasi Peptida untuk Imobilisasi Enzim. PLoS ONE 6(4):e18692. https://doi.org/10.1371/journal.pone.0018692 https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0018692
Kesimpulan
Jadi, jelas ada strategi yang berbeda untuk melumpuhkan biomolekul pada permukaan bahan untuk mengontrol respon imun atau proses diferensiasi.
Sebelum memilih salah satu metode imobilisasi, penting untuk mengetahui sifat bahan yang akan Anda gunakan dan kurva profil pelepasan biomolekul yang ingin Anda capai. Pendekatan terbaik adalah kombinasi metode konjugasi yang berbeda, mengingat bahwa sistem kekebalan tidak memiliki sifat statis. Ini menunjukkan variasi dinamis dari waktu ke waktu.
Pelapisan implan menggunakan nanomaterial (atau kompleks nanomaterial-biomolekul) untuk meningkatkan biokompatibilitas implan banyak digunakan saat ini. Namun, fakta ini sangat kontras dengan kasus fabrikasi scaffolds dengan konsentrasi bertingkat dari biomolekul yang dienkapsulasi atau terikat. Terlepas dari banyaknya aktivitas di bidang ini, saat ini tidak banyak perusahaan yang menyediakan perancah ini, dan masih banyak tindakan regulasi yang harus diselesaikan sebelum membawa produk ini ke pasar.
Itu artinya kita harus menunggu lebih lama lagi untuk bisa melakukan penyembuhan sempurna tanpa bekas luka. Tapi penantiannya, kemungkinan besar, tidak akan lama. Teknologi yang menjanjikan ini dapat digunakan dalam praktik medis sehari-hari dalam waktu beberapa tahun.